Traducción al español del artículo llamado Terapia de líquidos liberal versus restrictiva en pacientes críticos. Este artículo acaba de ser publicado en Intensive Care Medicine. Silversides, Malbrain y Perner hacen un análisis del uso de líquidos en pacientes críticos y su efecto fisiopatológico. Los autores se decantan por la restricción al considerar al líquido administrado como una droga.
A pesar del intento de imparcialidad y objetividad, no hay duda que hay sesgo, razonable o no, en el análisis.
El artículo está englobado en la iniciativa FOAM, que aboga por el acceso libre a la educación médica, de la cual el Dr. Malbrain es uno de los principales promotores.
Silversides JA, Perner A & Malbrain MLNG. Intensive Care Med (2019). https://doi.org/10.1007/s00134-019-05713-y
Liberal versus restrictive fluid therapy in critically ill patients
La administración de líquidos endovenosos es una de las terapias más frecuentemente aplicadas en cuidado crítico, y se ha desarrollado desde el reemplazo del agua y electrolitos en la enfermedad diarreica hasta el concepto de “optimizar” el gasto cardíaco y así, esto es con frecuencia incorrectamente asumido como perfusión titular (1). Tal como el cuidado crítico trasciende desde un enfoque histórico sobre la normalización de la fisiología hacia la rigurosa aplicación de las prácticas basadas en evidencia, una re-evaluación del papel de las terapias básicas, tales como los líquidos endovenosos, es necesaria.
El shock se describe de manera típica por su origen como hipovolémico (ej, hemorrágico), distributivo (ej, séptico), obstructivo, cardiogénico, o neurogénico, con frecuente sobreposición. Aunque debería prestarse especial consideración a la etiología de la hemodinamia anormal en la UCI, con el tratamiento específico dirigido a las causas probables y, de forma crucial, a la presencia o ausencia de hipoperfusión asociada, en nuestra experiencia, con frecuencia, este no es el caso. Dado que la hipovolemia es la causa mas rápidamente reversible del shock, una aproximación “liberal” usando bolos de líquidos endovenosos como respuesta inicial a una variedad de situaciones hemodinámicas, incluyendo hipotensión, taquicardia, oliguria, moteado o parcheado cutáneo, y niveles elevados de lactato, es común (2,3).
Esta aproximación es consistente con las guías internacionales de manejo inicial de la sepsis (4), y con frecuencia continúa a través de la duración de la enfermedad crítica, frecuentemente sin consideración cuidadosa de las probables consecuencias beneficiosas versus las nocivas (2).
Eficacia de la administración endovenosa de líquidos
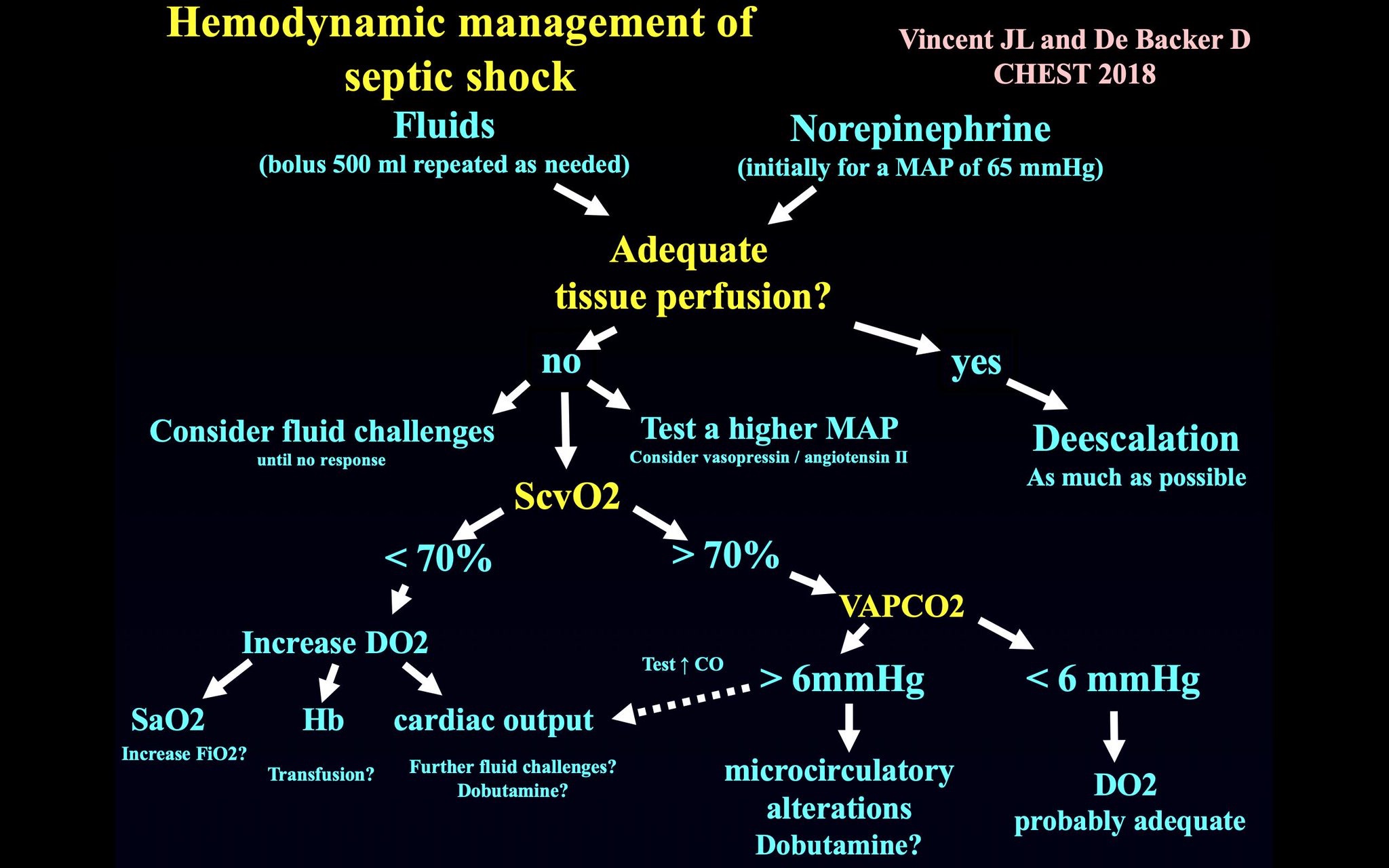
Aunque los pacientes que se presentan a un Departamento de Emergencias (Urgencias) pueden estar profundamente hipovolémicos e inicialmente pueden responder a líquidos endovenosos, los efectos se atenúan rápidamente con el tiempo. En un reciente estudio aleatorizado de resucitación con líquidos guiada por lactato versus guiada por perfusión periférica en sepsis, menos del 5% de los pacientes fueron reactivos a líquidos a las 8 horas de la presentación (Fig. 1)(5). Esto también es el caso en los pacientes ingresados directamente desde Urgencias a la UCI, para el momento en que los pacientes llegan a la UCI, por tanto, la capacidad de respuesta a líquidos es quizás la excepción más que la regla. De hecho, los efectos fisiológicos de los bolos de líquido dados en la UCI parecen ser pequeños. En análisis post hoc de estudios aleatorizados de SDRA y sepsis (7), el aumento medio en la presión sanguínea luego de un bolo de líquidos fue del orden de 2 mmHg y el descenso de la frecuencia cardíaca de 1 lpm, sin cambios en el gasto urinario, y aún estos modestos beneficios frecuentemente se disipan después de tan poco como 1 hora (8). Estos datos están en franco contraste con las percepciones reportadas por los clínicos de eficacia de casi 70% de los bolos de líquidos (2).
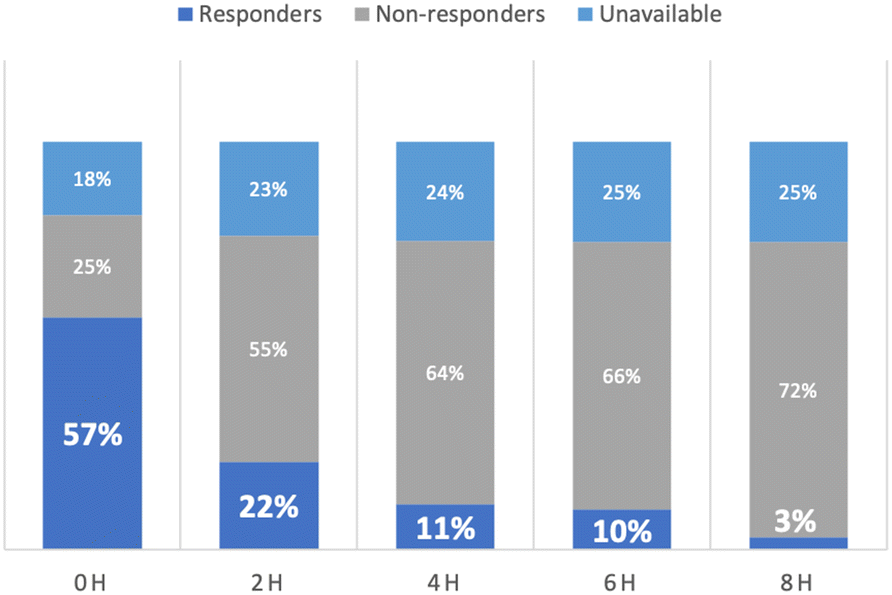
Fig. 1 Reactividad a líquidos (en %) sobre el tiempo en 424 pacientes con sepsis.
Peligro potencial de la administración de líquidos
En este contexto de gran ingreso de volumen de líquidos, junto con respuestas endocrinas y renales las cuales predisponen a excreción reducida de agua y sal, la acumulación de un balance positivo de agua y sodio es común. La acumulación de líquidos en pacientes críticos está consistentemente asociada con resultados adversos. Esto ha sido demostrado ahora en adultos y niños con sepsis, SDRA (9), y lesión renal aguda (AKI) (10), así como también en cohortes más amplias de enfermedad crítica (11).
La cuestión residual es si esto representa una relación causal o es simplemen
te confusión por indicación, con pacientes que están peor teniendo más probabilidad de recibir volúmenes más grandes de líquido y menos probabilidad de someterse a medidas de limitación de esta acumulación de líquidos. Un asunto adicional es si el peligro, si existe, es debido a la administración o a la acumulación de líquido y sodio, dado que los datos experimentales implican a ambas (12). Los mecanismos potenciales de daño de los bolos rápidos de líquido incluyen la lesión por desgarro del glicocálix endotelial, la frágil barrera por la que el líquido es mantenido dentro del espacio intravascular, vasodilatación y respuesta adrenérgica disminuida (13), mientras que la acumulación de líquido puede resultar en hemodilución, presión venosa elevada con disminución resultante en los gradientes de perfusión, y edema intersticial con inhibición resultante de la difusión de oxígeno entre los capilares y las células (14).
Ampliamente hablando, pueden usarse dos abordajes complementarios en la prevención y tratamiento de la sobrecarga de liquido: administración restrictiva de líquidos, y la remoción activa de líquidos acumulados. Ls diferentes fases que siguen a la resuscitación inicial y la remoción subsiguiente de líquidos se ilustran y explican en el modelo ROSE (ESM 1)(1).
Administración restrictiva de líquidos
Se ha puesto considerable énfasis en identificar predictores de la «reactividad a fluidos”, esto es, parámetros fisiológicos o ecocardiográficos tales como la variación del volumen latido (3), las maniobras de elevación pasiva de piernas (15), o la integral velocidad tiempo (16) para predecir si un bolo de líquido producirá alguna mejora en las variables hemodinámicas. Una razón para estos predictores es limitar la administración de líquidos a situaciones en las que hay al menos una posibilidad de beneficio clínico.
Aunque incorporar predictores de reactividad a líquidos en la evaluación hemodinámica general parece intuitivamente razonable, quedan problemas inherentes aunque se usen de manera correcta. Primero, administrar líquidos hasta que un estado de arreactividad a líquidos sea alcanzado nunca se ha demostrado que sea de beneficio en sepsis. Segundo, cada uno de los predictores esta sujeto a limitaciones mayores, por ejemplo, la variación de volumen latido no es útil en el contexto de la ventilación protectora de pulmón, la respiración espontánea, las arritmias cardíacas, la insuficiencia cardíaca derecha o la presión intra-abdominal aumentada (3). Tercero, aun si la predicción de la reactividad a líquidos es precisa, las medidas usadas para juzgar el “éxito” o “fracaso” de un bolo de líquidos son parámetros globales tales como la tensión arterial o el gasto cardíaco, que son predictores pobres de la perfusión titular, particularmente en sepsis donde la coherencia entre la macro y la micro-circulación frecuentemente está perdida (14).
Para reducir la administración de líquidos puede necesitarse el uso precoz de vasopresores. La aplicación precoz de vasopresores tiene el potencial de reducir el déficit intravascular de volumen reclutando sangre del compartimiento venoso, mientras evita los efectos deletéreos de la administración de líquidos (17). Retardar el uso de vasopresor hasta que la resuscitación con líquidos haya fallado ostensiblemente en corregir el shock, por otra parte, puede retardar la resolución, y asume que la resuscitación con líquidos es más segura que el uso de vasopresores, una presunción que es contraria a los datos disponibles (18, 19) y que puede ser impulsada en parte por la restricción de recursos.
Deresucitación
Aunque el uso más restrictivo de líquidos, junto con el uso más precoz de vasopresores si es necesario, puede reducir la administración de líquidos, es improbable que la sobrecarga de líquidos pueda ser evitada totalmente con esta estrategia. El ingreso de líquidos en la UCI viene de un rango de fuentes, y muchas son obligatorias tales como los diluyentes de drogas y la nutrición. Un estudio reciente demostró que este “arrastre de líquidos” explica tanto como un 33% de todo el ingreso de líquidos comparado con 7% para los líquidos de resucitación (20). Al lado de la restricción de los líquidos de resucitación, evitar la sobrecarga de líquidos es probable que requiera deresucitación, definida como la remoción activa de líquidos usando diuréticos o ultrafiltración (11), un abordaje que acorta la duración de la ventilación mecánica y la estancia en UCI (9). La co-administración de albúmina hipertónica junto con diuréticos puede promover la estabilidad hemodinámica y la diuresis (21, 22).
La investigación actual está enfocada en 3 principales áreas: (1) abordajes restrictivos a la resucitación con líquidos, involucrando el uso precoz de vasopresores si es necesario, (2) el uso de medidas de deresucitación para evitar y tratar la acumulación de líquidos luego de la resucitación, y (3) la búsqueda de herramientas que puedan predecir los pacientes quienes se beneficiarán de los líquidos de los que no. Mientras tanto, los clínicos deberían buscar evitar la administración de líquidos donde es improbable que sea de beneficio, esto es, donde la perfusión es adecuada, aun si los vasopresores son necesarios, o cuando la perfusión es inadecuada pero la reactividad a líquidos es improbable. Luego de la resucitación, el uso de diuréticos o de ultrafiltración para minimizar la sobrecarga de líquidos parece seguro y puede acelerar la recuperación de la enfermedad crítica. Esto se refleja en las fases dinámicas (ROSE) del manejo de líquidos.
Finalmente, aunque estos representan principios ampliamente aplicables, el refinamiento de las mediciones fisiológicas o de los biomarcadores puede permitir un abordaje más personalizado para el manejo de líquidos en el futuro. En analogía al concepto bien conocido de la vigilancia antibiótica, es tiempo para la vigilancia de líquidos en el paciente crítico, en el que los líquidos deberán ser tratados como drogas.
Ver las referencias en el artículo original
Me gusta esto:
Me gusta Cargando...